产品资料 – 糖生物学与蛋白质工具 – 蛋白磷酸酶
Sodium Orthovanadate (Vanadate)
#P0758L 5 ml
#P0758S 1 ml
Description

Properties and Usage
![]()
Notes

References
![]()

![]()

![]()
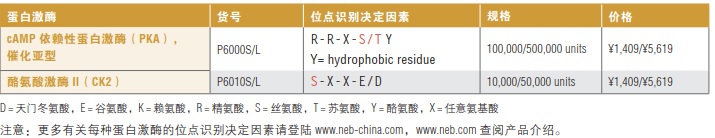
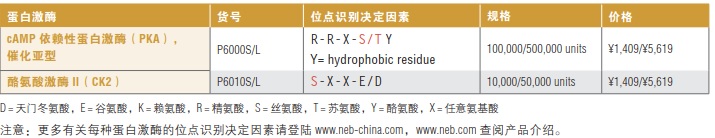
O-糖蛋白酶是一种高度特异性的蛋白酶,用于切割糖蛋白或糖肽上的肽键,该酶特异性识别粘蛋白型 O-连接糖(无论是否唾液酸化)的丝氨酸或苏氨酸残基,在其 N端进行切割。
·用于 O-糖基化位点测定和 O-糖结构测定
·有效切割糖蛋白(无论是否唾液酸化),无需神经氨酸酶处理
·为重组酶,无其它蛋白酶污染
·可在变性或非变性条件下使用
·不含甘油,便于在 HPLC 和 MS 分析中取得最佳效果。
·以溶液形式提供;具有长达 24 个月的最佳活性和稳定性
O-糖蛋白酶是一种高度特异性的蛋白酶,用于切割糖蛋白或糖肽上的肽键,该酶特异性识别粘蛋白型 O-连接糖(无论是否唾液酸化)的丝氨酸或苏氨酸残基,在其 N 端进行切割。O-糖蛋白酶含有 6 × His-tag,使用镍亲和树脂可轻松从反应体系中去除
来源:
基因克隆自铜绿假单胞菌(Pseudomonas aeruginosa),在 E. coli 中表达。
![]()
1 mg/ml。
![]()
16,000 U/ml。
![]()
2,000 units/ml。
![]()
2X GluC 反应缓冲液。
29,849 daltons。
![]()
来自牛(Bos taurus)胰脏。
2X 胰蛋白酶-ultra 反应缓冲液。
23,675 daltons。
![]()
2X AspN 反应缓冲液。
40,089.9 daltons。